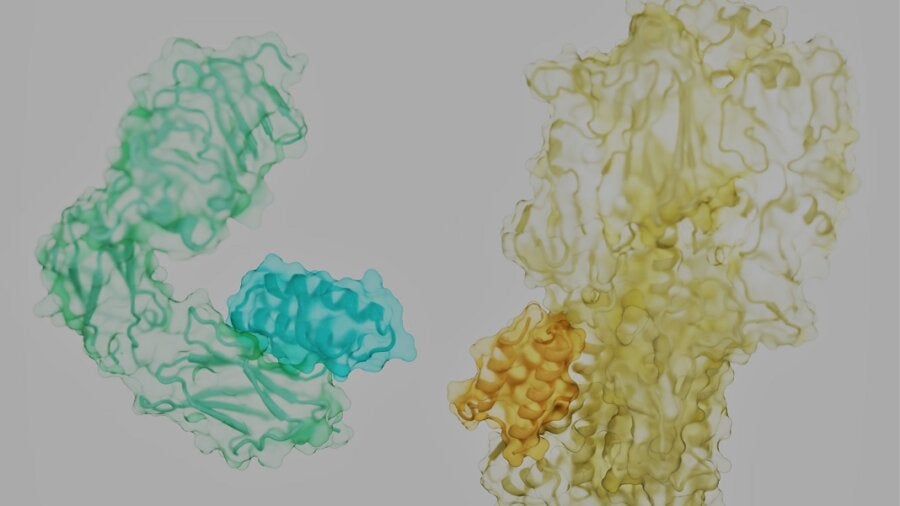
控制我们生活的蛋白质就像滚滚的风滚草。每个都有一个纠结的、独特的形状,表面上点缀着尖刺的侧枝。如果我们能找到正确的钥匙,隐藏在角落和缝隙中的是与我们最臭名昭著的敌人——癌症、糖尿病、感染甚至衰老——战斗的锁。
我们刚刚得到了一个万能钥匙制造商。在预印本中,华盛顿大学的大卫贝克博士领导的一个团队开发了一种算法来设计微小的蛋白质钥匙,从头开始解锁这些目标。该算法远非象牙塔般的追求,而是解决了我们这个时代最令人头疼的药物发现挑战之一:我们能否仅根据蛋白质锁的结构设计药物?
他们不是在谈论任何药物。该团队没有专注于泰诺等小分子,而是将注意力转向了被称为“粘合剂”的蛋白质样分子。虽然它们可能听起来很异国情调,但你知道它们。单克隆抗体就是一个例子,它一直是治疗重症 Covid-19 病例的关键。它们也是我们对抗癌症的最佳武器之一。但这些治疗巨头难以进入细胞,难以制造,而且通常昂贵得无法广泛使用。
替代方案呢?我们能否利用现代计算的力量,设计出类似但更小、更简单的药物,如果不是更有效的话?
根据贝克团队的研究,答案是肯定的。该算法筛选了 12 个蛋白质靶标的近 50 万个候选结合结构,完成了它的任务,与以前的尝试相比使用了最少的计算能力并突出了潜在的命中。它还发现了一个“作弊代码”,可以让活页夹更有效地抓住他们的目标。
关键在于:与以前的工具不同,该软件只需要目标蛋白质的结构就可以从头开始设计粘合剂“键”。与以前的尝试相比,这是一种简单得多的方法。而且由于蛋白质运行着我们内部的生物宇宙,这意味着新的软件密钥制造者可以帮助我们解开细胞分子生命的秘密——并在它们出错时进行干预。
贝克说:“能够产生与您想要的任何分子靶点紧密且特异性结合的新蛋白质的能力是药物开发和分子生物学更广泛的范式转变。”
蛋白质粘合剂什么?
我们的身体由大量的蛋白质组成。就像舞厅里的妓女一样,每一种蛋白质都会在细胞周围弹跳,暂时抓住另一种蛋白质,然后让它们去寻找下一种蛋白质。特定的配对可以启动细胞图来触发或抑制戏剧性的细胞过程。有些人可能会引导细胞生长或平静地死去。其他人可能会使细胞癌变或衰老,泄漏有毒化学物质并危及附近的细胞。
换句话说,蛋白质配对对生命至关重要。它们也是一个强大的医学黑客:如果任何一对触发了一个信号级联,伤害了细胞或组织,我们可以设计一个“门挡”分子来真正打破配对并阻止疾病。
问题?想象一下,试图通过向它们投掷一根短而灵活的棍子来分离两条在高速公路上滚动的缠绕在一起的风滚草。这似乎是一项不可能完成的任务。但这项新研究提出了成功的秘诀:关键是找到将两者分开的地方。
翻墙
蛋白质通常被描述为链上的珠子,被揉成复杂的 3D 结构。这并不完全正确。构成蛋白质的分子“珠子”更像是类人机器人,躯干僵硬,四肢松软,被称为“侧链”。
当蛋白质组装时,它将其组成氨基酸的主干成分连接成一个坚固的骨架。像毛线球一样,卷曲的暴露侧链覆盖了蛋白质的表面。根据它们的位置和骨架,它们形成天然蛋白质伴侣或模拟物可以很容易抓住的口袋。
以前的研究利用这些口袋设计了模拟活页夹。但这个过程的计算量很大,并且通常依赖于已知的蛋白质结构——一种并不总是可用的宝贵资源。另一种方法是寻找目标蛋白上的“热点”,但这些“热点”并不总是能被结合剂接触到。
在这里,团队以类似于攀岩者试图攀登一堵新墙的方式解决了这个问题。攀登者是粘合剂,墙壁是目标蛋白质表面。抬头看,有很多由侧链和蛋白质袋制成的把手和立足点。但最大的“热点”不一定能容纳登山者的路线。
团队解释说,另一种方法是绘制所有的持有点,即使有些看起来很弱。这开辟了一个新的潜在结合点世界——大多数会失败,但一些组合可能会出人意料地成功。然后,成千上万的登山者挑战这些点的一个子集,每个人都试图确定一条有前途的路线。一旦顶级路线出现,第二轮登山者将详细探索这些路线。
“按照这个类比,我们设计了一种多步骤的方法来克服”以前的挑战,该团队说。
首先,该团队扫描了一个潜在的蛋白质骨架库和大量可以锁定蛋白质靶标的侧链位置。
最初的样本量很大。每个目标都出现了数千个潜在的蛋白质主链“主干”和近十亿个可能的侧链“臂”。
在 Baker 团队开发的蛋白质结构和功能绘图程序Rosetta的帮助下,该团队将选择范围缩小到少数有前途的结合剂。
贝克实验室所在的蛋白质设计研究所首席战略和运营官兰斯·斯图尔特博士说,这些粘合剂的选择依赖于“传统物理学”,没有利用机器学习或深度学习能力。它“使这一突破更加令人印象深刻。”
指导生活
下一个大问题:所以粘合剂可以在 silico中绑定。但它们真的在细胞中起作用吗?
在概念验证中,该团队挑选了 12 种蛋白质来测试他们的算法。其中包括与癌症、胰岛素和衰老密切相关的蛋白质。另一组专注于对抗病原体,包括流感的表面蛋白或 SARS-CoV-2,即 Covid-19 背后的病毒。
该团队为每个蛋白质目标筛选了 15,000–100,000 个结合剂,并测试了大肠杆菌中的最佳候选者。正如预期的那样,粘合剂在阻断目标方面非常有效。有些会切断可能导致癌症的生长信号。其他人则针对流感的一个共同区域——流感——理论上可以中和多种病毒株,为通用流感疫苗铺平道路。甚至 SARS-CoV-2 也没有幸免,“超强”粘合剂可以防止其入侵小鼠(这些结果之前已发表)。
该研究表明,从头开始设计蛋白质样药物是可能的。它所需要的只是目标蛋白质的结构。
“应用的可能性似乎无穷无尽,”英国剑桥 MRC 分子生物学实验室的结构研究联合负责人Sjors Scheres 博士在 Twitter 上说,他没有参与这项研究。
该算法虽然功能强大,但并不完美。尽管找到了数百万个潜在的粘合剂,但只有一小部分设计真正锁定了他们的目标。即使是最好的候选者也需要对其氨基酸组成进行多次改变,以实现与目标的最佳结合。
但对于一个可以从根本上改变医学的领域来说,这是一项开创性的工作。目前,该方法和大型数据集“提供了一个起点”来弄清楚蛋白质如何在我们的细胞内相互作用。反过来,这些数据可以在良性循环中指导更好的计算模型,尤其是在增加深度学习魔法的情况下。
它将“进一步提高设计的速度和准确性,”斯图尔特说。这是“我们实验室已经在进行的工作”。
图片来源:Longxing Cao、Brian Coventry、David Baker、UW Medicine