大脑是一个耗氧器官。它主要由需要能量提升以向邻居发出信号的电活性细胞组成,消耗人体 20% 的氧气供应。它本身没有能量储存,它依赖于一个血管网络,这些血管网络可以精确地在正确的时间将氧气和葡萄糖输送到工作的神经元。
维持这种复杂的运输系统,它兼作保护性血脑屏障,将毒素和病原体排除在大脑之外,对大脑功能和整体健康都至关重要。研究表明,大脑的血管会随着年龄的增长而恶化,这使得我们不仅更容易受到中风等血管疾病的影响,而且更容易受到神经退化和认知能力下降的影响。
尽管它们发挥着关键作用,但供应大脑的血管在很大程度上仍然是未开发的领域。脑血管系统的细胞几乎没有受到神经元或神经免疫细胞(如胶质细胞)的关注。 Lee Rubin说,构成身体和大脑之间这一关键接口的细胞位于无人区——传统上不属于神经科学家的领域,但研究人员也很少关注血管的发育和功能。是哈佛大学的神经科学家,也是西蒙斯可塑性和大脑老化合作组织的研究员。但这种情况开始改变。
2022 年初,三个研究小组独立描述了构成人脑血管系统的细胞的第一个分子图谱。通过逐个细胞地分析基因表达,他们发现了新的细胞亚型并检测了已知疾病相关基因的表达模式,这表明血管变化可能是阿尔茨海默病和亨廷顿病病理学的关键。预计新的细胞普查将帮助研究人员探索脉管系统的分子变化如何破坏大脑功能,以及靶向脉管系统细胞如何有助于预防认知能力下降和其他大脑功能障碍。
这些发现对研究大脑衰老的研究人员特别感兴趣。随着年龄的增长,大脑的血管系统会退化,变得不那么密集,功能也越来越少,从而减少了流向脑细胞的血流量。此外,越来越多的研究表明,血液中的因子可以使老化的大脑恢复活力,但研究人员并不知道确切的方法。大脑脉管系统的详细地图将为研究人员提供更好的基线,以精确研究它如何随年龄而变化。它还可能有助于解释血液携带的因子如何使老化的大脑恢复活力,并可能暗示增强它们的方法。 (更多内容请参见“ 探寻年轻血液如何让大脑恢复活力的秘密”)
Tony Wyss- Coray 是斯坦福大学神经科学家和 SCPAB 研究员,他领导了其中一个新地图集的开发,他希望这些发现将开辟神经科学研究的新前沿。 “人们最初只关注神经元,这总是让我感到惊讶,”他说。 “对其他细胞类型的兴趣为零。”他说,长期以来,与神经退行性疾病相关的基因突变被认为直接导致神经元功能障碍。近年来,这种情况发生了变化,因为大脑的常驻免疫细胞——神经胶质细胞——变得越来越重要。但这种观点仍然过于狭隘,Wyss-Coray 说。 “我们希望通过这篇论文告诉人们……大脑中实际上还有很多其他细胞。”
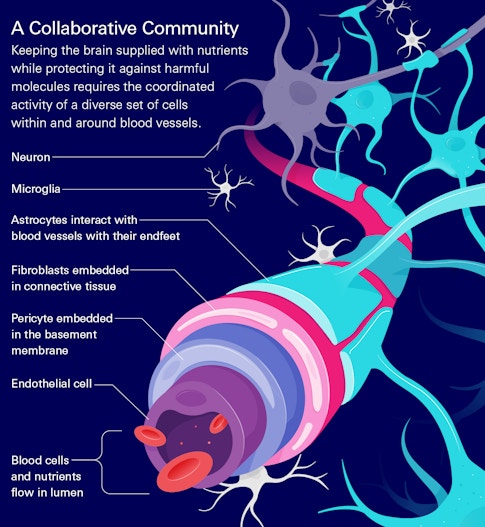 露西·雷丁-伊坎达
露西·雷丁-伊坎达一个协作的蜂窝社区
为大脑提供血源性营养,同时保护大脑免受有害分子的侵害,需要多种细胞的协调活动。其中许多类似于构成身体其他部位血管的细胞。但是由于它们与它们所支持的神经元的独特关系,它们都有自己的身份。排列在大脑血管内的内皮细胞与提供结构的成纤维细胞、调节血流的肌肉细胞、介导与神经元相互作用的周细胞、星形胶质细胞和其他有助于维持血脑屏障的免疫细胞密切相关。
尽管血脑屏障通常被认为是几乎无法穿透的隔板,但 Wyss-Coray 发现许多蛋白质通过血管壁进入大脑。在 2020 年发表的研究中,他的团队发现老鼠的大脑中有大量蛋白质摄取。老年动物对血源性蛋白质的摄取减少了一半,这反映了分子在血管壁上的运输方式与年龄相关的变化。随着动物年龄的增长,将特定蛋白质运送到大脑所需的蛋白质会减少。与此同时,一种选择性较低的运输形式变得越来越普遍,允许以前从大脑中排除的分子穿过屏障。
许多因素可能会加剧与年龄相关的血管屏障特性的丧失,例如密封相邻内皮细胞之间空间的闩锁样蛋白质的丧失。屏障的下降伴随着脑血管系统的其他与年龄相关的变化。在衰老动物中观察到的结构变化包括毛细血管密度降低、动脉壁变硬和小血管曲折增加。随着年龄的增长,血流与神经活动的协调性也可能变得不那么紧密。
许多神经科学家怀疑像这样的变化——无论是由于正常衰老还是由于神经退行性疾病的早期阶段——为大脑更严重的功能丧失奠定了基础。 “阿尔茨海默病、亨廷顿病、肌萎缩侧索硬化症和其他与年龄相关的神经退行性疾病的一个共同特征是,血脑屏障功能障碍和脑血管异常通常先于更明显的疾病特异性症状,通常是几十年,”神经科学家Myriam Heiman说。麻省理工学院。 “如果我们能够理解其基础,这可能是一种延迟或抑制与年龄相关疾病的某些疾病过程的方法。”
绘制边界
大多数关于脑血管系统的研究都集中在老鼠身上。虽然这项工作提供了丰富的信息,但小鼠和人类之间存在显着差异。 “脉管系统的复杂性——密度、神经胶质细胞包裹的数量、辅助细胞——与神经系统的复杂性成比例,”Heiman 说。这对理解人类衰老和疾病以及治疗产生了影响:例如,在动物模型中测试的许多实验化合物在临床上都失败了,因为它们无法穿过患者的血脑屏障。
由于几个原因,创建人脑血管系统的细胞分辨率图一直具有挑战性。血管细胞的数量远远超过神经元和神经胶质细胞,以至于在全脑分析中它们在很大程度上被忽视了。它们还陷入了一个细密的矩阵中,因此很难将它们彼此分开。 Wyss-Coray 说,虽然在为单细胞 RNA 测序准备完整的脑组织时,某些类型的血管细胞的细胞核可能会被保留,但其他血管细胞的细胞核可能会被破坏或留下。
为了克服这些障碍,Wyss-Coray 的小组以及由 Heiman 和 MIT 计算生物学家Manolis Kellis领导的小组设计了从珍贵的死后脑样本中从构成脉管系统的复杂细胞混合物中分离细胞核的方法。 Heiman 和 Kellis 还包括在波士顿儿童医院的神经外科手术中从患者大脑中取出的组织,将样本送回实验室并在一小时内进行处理。总而言之,这两组从健康的大脑和受神经退行性疾病影响的大脑中收集了超过 150,000 个细胞核用于单细胞分析。
使用 RNA 测序,研究小组为每个细胞生成了完整的基因表达谱。 Heiman 和 Kellis 将健康人的大脑与亨廷顿病患者的大脑进行了比较,而 Wyss-Coray 则研究了健康大脑和受阿尔茨海默病影响的大脑之间的差异。两项研究均于 2 月发表在《自然》杂志上。第三组由加州大学旧金山分校的神经科学家Tomasz Nowakowski领导,进行了类似的分析,使用单细胞转录组比较健康人类脑血管系统的细胞组成与在称为动静脉畸形的异常血管缠结中发现的细胞组成,一种增加中风风险的罕见疾病。研究小组对健康大脑的分析发现了意想不到的细胞多样性,包括几个值得注意的惊喜。
Wyss-Coray 以及 Heiman 和 Kellis 的研究小组都发现,基于不同的基因表达模式,形成血液和大脑之间大部分界面的大脑周细胞可以分为两种亚型。 Wyss-Coray 说,一个小组看起来专门用于通过血脑屏障运输物质,而另一组可能专门用于构建和维持围绕细胞并构成大部分血管壁的基质。同样,新图谱首次描述了成纤维细胞,这是一种在人脑中产生细胞外基质的细胞。根据 Heiman 和 Kellis 的说法,细胞命运通路中的遗传活动表明,一些大脑的成纤维细胞可能能够分化成周细胞,这与其他人在斑马鱼大脑中的观察结果相呼应。
 人类和小鼠的脑血管系统内的基因表达模式不同。在左侧,标记为绿色的 ANO2 蛋白出现在人皮层的内皮细胞内,与标记为红色的内皮细胞标记凝集素共定位。在右侧的小鼠皮层中,内皮细胞中不存在 ANO2 蛋白。加西亚等人。自然,2022 年。
人类和小鼠的脑血管系统内的基因表达模式不同。在左侧,标记为绿色的 ANO2 蛋白出现在人皮层的内皮细胞内,与标记为红色的内皮细胞标记凝集素共定位。在右侧的小鼠皮层中,内皮细胞中不存在 ANO2 蛋白。加西亚等人。自然,2022 年。从这些分析中得出的关键教训之一是小鼠和人类之间的显着差异,这对于研究人员努力了解疾病可能很重要。 “小鼠大脑和人类大脑之间的基因表达并不像我们预期的那样保守,”Wyss-Coray 说。他指出,一些已在小鼠脉管系统中研究过的基因,甚至用作细胞类型标记物,在人类脉管系统中的不同细胞类型中都有活性——在某些情况下根本不活跃。 “如果你试图了解脉管系统的功能或推断基因在疾病中的可能作用,那将是一个大问题,”他说。研究人员还发现,在小鼠和人类之间,其表达模式沿血管不同部位变化的基因(这种现象称为“分区”)在小鼠和人类之间存在差异。由于这些差异,Wyss-Coray、Heiman 和 Kellis 一致认为,培养的人类细胞和组织,包括干细胞衍生模型,对于充分了解脉管系统在人类衰老和疾病中的作用可能是必要的。
探索衰老和疾病
研究人员希望他们的发现能够引起人们对构成脑血管系统细胞的多样性以及这些细胞如何促进大脑功能的关注。 Wyss-Coray 以及 Heiman 和 Kellis 的研究都发现,以前与疾病相关的基因在这些细胞中是活跃的,并且健康个体与阿尔茨海默病或亨廷顿病患者的表达模式不同。 Heiman 说,了解脑血管系统在疾病中的作用对于了解神经退行性疾病的起源和开发新疗法都很重要,因为血管比它们支持和保护的神经元更容易接近。 “输送到血液中的治疗剂可以进入大脑的内皮细胞,”她说。 “所以现在我们有了一份亨廷顿病似乎失调的事物清单,从基因治疗到药理学研究,有许多有趣的方向。”
同样,随着现在仔细绘制健康大脑脑血管系统的分子组成,研究人员可以开始研究伴随认知能力下降的与年龄相关的变化。脑血管系统不同细胞类型的详细地图将更容易追踪基因表达和细胞功能如何随年龄变化,并寻找逆转这些变化的方法。
例如,在哈佛大学鲁宾的实验室中,研究人员正在探索恢复老化血管系统的全部功能和生长潜力的方法,这需要了解和靶向正确的细胞类型。虽然内皮细胞通常不会在成人大脑中增殖,但它们可以:它们的生长对于中风或创伤性脑损伤后产生新血管至关重要。鲁宾解释说,他的小组自己的单细胞分析已经确定了一个内皮细胞亚群,它们表达与有丝分裂和增殖相关的基因。 “他们没有动员起来,但它表明了靶向内皮细胞亚群的潜力,”他说。 “现在还为时尚早,但我觉得这将是一个有趣且重要的细胞研究工作。”